浙江微流纳米生物技术有限公司
一、概述已上市脂质体
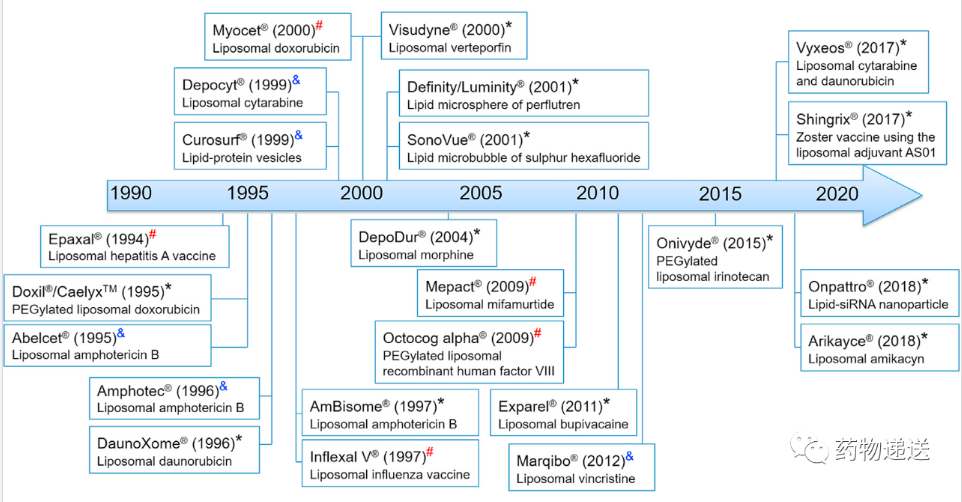
查阅相关的药物数据库,排出非专利药、脂质复合物和区域性获批的产品,共有14个脂质体产品获批上市。前列款上市的脂质体产品是1995年FDA批准的盐酸阿霉素脂质体注射液Doxil。在已上市的脂质体产品中,43%的产品是于2000年之前获批,57%的产品是于2010年之前获批。这些脂质体产品主要集中于肿瘤治疗,同时也涉及其他领域,比如感染、麻醉、疫苗、肺部疾病和光动力治疗。这些脂质体产品的剂型主要为无菌混悬液和冻干粉。给药途径包括静脉输注、肌内和鞘内注射、硬膜外给药、局部浸润和口服吸入。


二、已上市脂质体结构
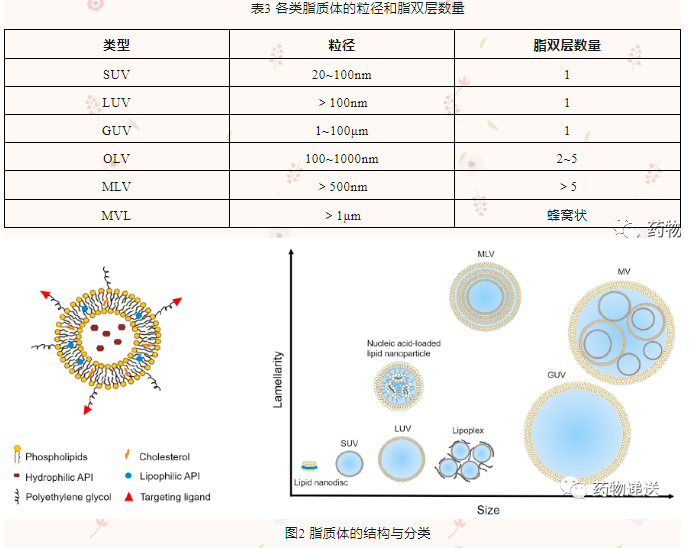
根据脂质体粒径的大小和脂质双层膜数量,可以将脂质体分为单室脂质体(Unilamellar vesicles,ULV);寡层脂质体(Oligolamellar vesicles,OLV,100-1000nm);多层脂质体(Multilamellar vesicles,MLV,>500nm);多囊脂质体(Multivesicular liposomes,MVL,>1000nm)。
单室脂质体(ULV)根据粒径大小又可分为小单室脂质体(Small unilamellar vesicles,SUV,30~100nm);大单室脂质体(Large unilamellar vesicles,LUV,>100nm);巨型单室脂质体(Giant unilamellar vesicles,GUV,>1000nm)。寡层脂质体(OLV)和多层脂质体(MLV)具有洋葱状结构,分别具有2~5和>5层同心脂质双层膜。与多层脂质体不同的是,多囊脂质体(MVL)包括数百个非同心的水性腔室,由单室双层脂膜包围,呈蜂窝状结构。
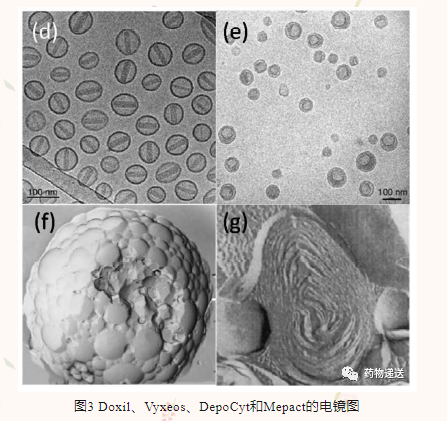
目前大多数商业产品设计都是延长循环时间提高半衰期,被动靶向于病变部位,因此大多数为SUV。阿米卡星脂质体吸入混悬液Arikaye中粒子粒径较大(200~300nm),被认为是LUV。注射用柔红霉素阿糖胞苷脂质体Vyxeos是一种双层脂质体,这种结构是在前列次载药阿糖胞苷的过程中形成的,内部薄层形成的机制被解释为一种热力学应答,脂质双分子层因外部渗透压渗入的水性介质而降低表面积和体积的比值。阿霉素脂质体Myocet和米伐木肽脂质体Mepact是MLV,大量的脂质层为包载亲脂性药物提供了足够空间。
有四种脂质体产品的粒径为微米级,分别是米伐木肽脂质体Mepact、阿糖胞苷脂质体混悬液DepoCyt、硫酸吗啡缓释脂质体注射液DepoDur和布比卡因脂质体注射用混悬液Exparel。Mepact为无菌冻干饼,以0.9%生理盐水复溶重组后形成粒径为2.0~3.5μm的多层脂质体,这种尺寸的粒子利于单核细胞/巨噬细胞识别和吞噬,并触发巨噬细胞和免疫调节作用的癌症治疗。DepoCyt、DepoDur和Exparel采用相同的DepoFoam技术生产。MVL在结构上由于有许多腔室,可以装载大量的药物溶液,并在脂质体的缓慢侵蚀/降解和药物分子的缓慢扩散下而实现持续释放。
三、已上市脂质体的成分
已上市脂质体使用的主要成分有甘油磷脂(GP)、鞘磷脂(SM)和胆固醇(Chol)。
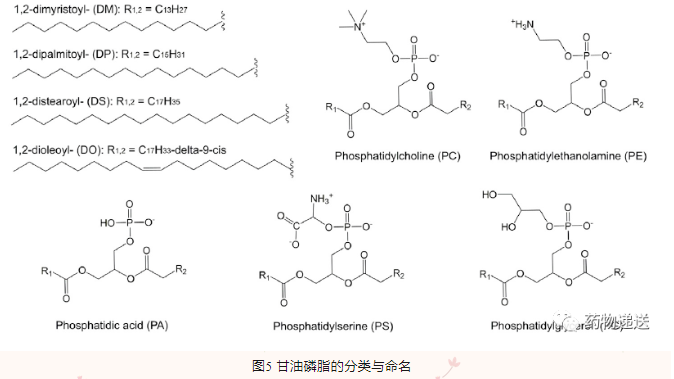
甘油磷脂(GP),是甘油连接一对疏水脂肪酸尾链和亲水极性头部。疏水脂肪酸尾链(R1和R2)可以是饱和或不饱和脂肪酸,如癸酸、月桂酸、棕榈酸、油酸、肉豆蔻酸、硬脂酸、芥酸等。亲水极性头部则可为磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)、磷脂酸(PA)、磷脂酰甘油(PG)和心磷脂。在生理pH环境中,PA、PS、PG和心磷脂呈电负性,PC和PE呈电中性。
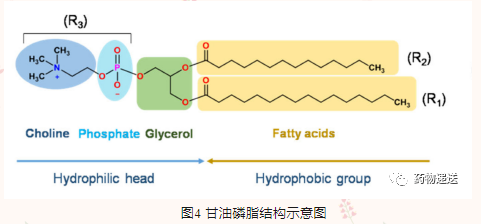
甘油磷脂在处方中发挥关键作用,因为它会影响脂质体的生物物理性质,如药物包载、稳定性和药物释放,还能进一步影响体内药代动力学行为和药效学。甘油磷脂烃链的长度、对称性、分子间和分子内相互作用、分支和不饱和程度决定脂质膜的厚度和流动性、相变温度和药物释放速率。总之,烃链越长脂质膜越紧凑,药物包载量就越大;而烃链不饱和度或分支度越高,脂质膜越松散,这可能是由于胆固醇优先与饱和磷脂相互作用。
鞘磷脂(SM)与甘油磷脂具有相似的结构,只是甘油被鞘氨醇取代。硫酸长春新碱脂质体注射液Marqibo采用鞘磷脂形成脂质双层膜,在酸性环境下显著降低脂质水解,改善脂质体稳定性。酸性环境(pH2.0~4.0)通常用于产生跨膜pH梯度,用于活性药物包载。在37℃和pH2.0的条件下,SM/Chol (55/45,mol/mol)脂质体的水解速度比DSPC/Chol脂质体约慢100倍。此外,含有SM/Chol的脂质体具有较佳的药代动力学特性,例如延长循环时间,提高药物的靶向递送效率和释放。

四、已上市脂质体的工艺
脂质体的制备方法多种多样。常用的制备方法有薄膜水化法、乙醇注射法、复乳法等。这些过程通常包括(1)根据需要的脂质体结构(MLV或ULV)选择合适的制备方法;(2)必要时控制粒径;(2)制备药液并载药,被动载药的情况下,该步骤与步骤1相结合;(4)必要时进行缓冲液置换和浓缩;(5)无菌过滤或无菌处理;(6)必要时冷冻干燥,并包装。
(1)薄膜水化法
薄膜水化法是一种利于包载脂溶性药物的传统方法。在真空下旋转蒸发脂质溶液,于烧瓶中形成薄膜。通过加入水溶液使脂质薄膜水化,形成多层脂质体(MLV)悬浮液。进一步减小粒径可获得小单室脂质体(SUV),并可在脂质体形成过程中被动载药或者脂质体形成后主动载药。
上市产品AmBisome、Visudyne和Shingrix(AS01B佐剂系统)采用该方法生产。例如,Visudyne是通过蒸发掉溶解原辅料的二氯甲烷形成薄膜、乳糖溶液水化、均质作用减小粒径、过滤、冻干生产而得。在Shingrix产品中,AS01B佐剂系统为单独一瓶,含两种免疫增强剂QS21(一种从树皮中提纯的三萜糖苷)和MPL(单磷酸酰脂质A)。MPL和其他脂质溶解在有机溶液并干化。经水化并减小粒径后,加入QS21水溶液配制而成。
(2)复乳法
复乳法也被叫做DepoFoamTM技术平台,该技术目前已用于上市的三款多囊脂质体的生产,分别是阿糖胞苷脂质体混悬液DepoCyt、硫酸吗啡缓释脂质体注射液DepoDur和布比卡因脂质体注射用混悬液Exparel。
整个生产过程通常包括如下四个步骤:(1)形成油包水(W/O)乳液;(2)形成水包油包水(W/O/W)乳液;(3)在真空压力或者气流下除去有机溶剂;(4)微孔过滤除去游离药物,并对药液进行外水相置换和浓缩。生产过程中,因为多囊脂质体的粒径不能通过0.22μm滤芯进行过滤除菌,只能对整个生产过程提供无菌保证。
在生产工艺对布比卡因关键质量属性影响的研究中,发现初乳的粒径随脂质浓度的增加而变大,剪切速度对初乳粒径也有较大影响。复乳过程中,由于去除溶剂的过程会引起部分多囊脂质体坍塌,从而造成药物从内水相中泄露降低包封率。此外,高温会促进脂质膜的流动和重排,引起脂质腔室坍塌。
(3)溶剂注入法
溶剂注入法是将脂质材料和亲脂性物质溶解在可溶于水的有机溶剂中,然后将有机相注入大量的水相缓冲液中,自发形成小单室脂质体。在其他改进的方法中,两股溶液通过管中的Y接头、膜接触器或者切向流设备注入混合,以改善有机相进入水相的微观混合。
脂质溶剂在水溶液中迅速扩散,在界面湍流作用下形成小而均匀的脂质体。根据不同的制备条件,可以制备80~300nm之间的粒径,不需要额外的能量(如声和挤出)用于粒径控制。有机溶剂应通过蒸发、冻干、透析或透滤去除,脂质体悬浮液可浓缩到所需体积。乙醇因其安全性较高而被广泛用作有机溶剂。制备方法的各种参数会影响脂质体的性质,包括流速、溶剂和水溶液温度、脂质浓度以及搅拌速率。阿米卡星脂质体吸入混悬液Arikayce采用乙醇注入法制备脂质体。将小至量的脂质乙醇溶液和硫酸阿米卡星水溶液通过Y型连接器和在线混合器混合,形成纳米级阿米卡星脂质体。
(4)原位制备法
“原位”被认为是在临床使用前形成的脂质体。米伐木肽脂质体Mepact是采用了这种方法进行生产的。药物和磷脂配制成散装溶液,然后过滤灭菌、灌装和冻干。Mepact只包含活性成分胞壁酰三肽磷脂酰乙醇胺(MTP-PE)、棕榈酰油基磷脂酰胆碱(POPC)和二油酰磷脂酰丝氨酸(OOPS)三种成分,其比例固定为POPC:OOPS= 7:3,MTP-PE:磷脂=1:250。该产品是一种具有多孔结构的干燥脂质饼,为缓冲介质复溶接触提供较大的表面积。临床使用前,在小瓶中加入0.9%生理盐水,将冻干粉水化形成粒径为2.0~3.5μm的多层脂质体,粒径分布为单峰型。磷脂在水中的相变温度约为5℃,因此能在室温下原位制备成脂质体。

粒径和粒度分布是影响脂质体性能和安全性的关键因素。用于脂质体粒径控制的方法有水浴声或探针声、弗氏压碎器(Frenchpress)法、挤出法、均质法或组合法(冻融挤出法、冻融声法、高压均质挤压技术)。在这些技术中,挤出技术(Extrusion)和高压均质技术(High-Pressure Homogenization,HPH)是脂质体较常用的粒径控制技术。
(1)挤出技术
挤出技术较早于1971年提出。大粒径脂质体可以通过聚碳酸酯膜(50nm~5μm)或不对称陶瓷过滤器,成为粒径分布较窄的小粒径脂质体。商业化纳米脂质体产品如Onivyde、Vyxeos和Marqibo,皆使用这种方法进行商业化生产。该方法操作简单、重现性好,所需条件适中。该方法控制粒径的机制是多层脂质体于滤膜入口处破裂后在膜通道中重新排列。涉及到的关键工艺参数有聚碳酸酯膜的孔径尺寸、挤出次数、压力和流速,都会影响脂质膜的粒径和层数。虽然有研究表明挤出技术相比于冻融声、均质等技术更为高效,但同时也会降低药物包封率和改变不对称脂质体的结构。
(2)高压均质技术
高压均质技术被用于生产多种纳米制剂,除脂质体外还用于如纳米晶体、纳米乳剂等。它既适用于水体系,也适用于非水体系,从10L/h的实验室规模到100000L/h的大型商业化生产规模都能实现。上市脂质体产品中,包括Visudyne和AmBisome都使用这种方法商业化生产。多层脂质体悬浮液在高压下通过一个狭窄的间隙,在速度梯度的下经剪切力、湍流和流体空穴作用来破裂重组成粒径更小的脂质体。粒径大小和粒度分布由均质过程的参数决定,如压力、循环次数、流体冲击设计、流速等;同时也受样品性质的影响,如样品的组成和粘度以及初始粒径分度。随着压力的增加和循环次数的增加,粒子粒径和多分散性指数(PDI)降低,但也会导致包封效率降低。
较理想的产品设计是高载药量同时尽量减少辅料用量,达到预期的治疗药物浓度,减少给药体积,缩短给药时间。通常使用两种主要的载药技术,即被动载药和主动载药。此外,还有一些其他的药物包封方法,如药物-脂质共价偶联,被动和主动联合包封药物。
(1)被动载药
被动载药方法是在制备脂质体过程中对药物进行包封。药物能包载于内水相中,或者药物分子与脂质膜共价、离子、静电、非共价或空间相互作用嵌入脂质体双层膜中。这种方法的主要缺点是封装效率低,因此需要其他步骤去除样品中的游离药物。从专利和出版物了解到,使用被动载药方法的已上市脂质体产品包括AmBisome、Visudyne、Arikayce、DepoCyte、DepoDur和Exparel。
亲脂性药物
维替泊芬,又称苯卟啉衍生物单酸环A(BPD),是一种高度亲脂性分子,能有效促进药物进入脂质双分子层中。维替泊芬脂质体在均质后的包封率几乎为100%。
AmpB(AmBisome)由于其两亲性结构,在水和大多数有机溶剂中很难溶解。AmpB可以通过带正电的氨基与DSPG带负电的磷酸基形成缔合,紧密嵌入到脂质双分子层中。在pH为1.0~3.0的酸性环境中容易形成离子相互作用。此外,AmpB的多烯部分与磷脂的脂肪烃链之间的疏水作用也加强了离子缔合。
亲水性药物
硫酸阿米卡星(Arikayce)是一种高水溶性抗感染药物。由于阿米卡星在乙醇中的溶解度有限,在使用乙醇输注制备脂质体时,阿米卡星转变成半可溶性、凝聚状态,被包载于脂质体的内核中。这样制备的脂质体有较高的包封率(游离药物为5.2%)和脂药比(~0.7)。由于包载药物具有阳离子性质,使脂质体膜渗透性较低而在血液循环过程中具有更好的稳定性。
阿糖胞苷(DepoCyt)、吗啡(DepoDur)和布比卡因(Exparel)水溶液包载在多囊脂质体腔室中,其中水腔占94%,脂质占4%;因此,少量脂质体混悬液含有大量药物。为了进一步提高包封效率和缓释,可以将药物化合物从单质子无机酸盐转化为双质子或三质子无机酸盐(如硫酸盐或磷酸盐)和多醇有机酸共包载。
(2)主动载药
主动载药是在制备出空白脂质体后再进行载药。跨膜pH梯度或离子浓度梯度是促进药物跨膜扩散进入脂质体内核的驱动力。药物包埋过程约5~30min,可达到较高的载药效率(>90%)。
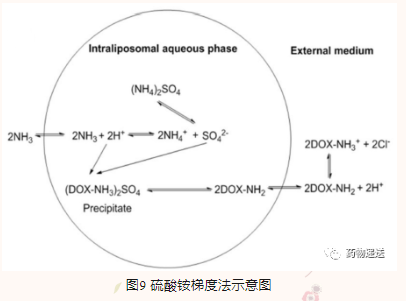
Doxil是基于硫酸铵梯度法主动载药的典型例子。由于脂质体核心(NH4)2SO4的浓度远高于外部介质,具有高渗透性和辛醇-缓冲分配系数的DOX-NH2中性分子在脂质体双层膜上扩散,进入脂质体内部水相。(DOX-NH3)2SO4在脂质体内水相中以纤维状结晶沉淀形式存在。(DOX-NH3)2SO4溶解度低,降低了脂质体内渗透压,从而保持了脂质体的完整性。
对于Myocet,该产品是在临床使用前包载DOX。跨膜pH梯度是包载DOX的驱动力。Myocet的包装中分为三个小瓶:盐酸阿霉素红色冻干粉,空白脂质体混悬液(pH=4.5的300mM柠檬酸),碳酸钠缓冲液。临床使用前,将空白脂质体混悬液注射到碳酸钠缓冲液中,脂质体外水相的pH值调节至7~8,再与DOX的生理盐水溶液混合即得。中性DOX分子(pKa= 8.3)在脂质体外水相中穿过脂质体双层膜,并在脂质囊泡内部形成独特的DOX-柠檬酸盐复合物。DOX-柠檬酸络合物以环堆叠在一起构成束状柔性纤维,包封效率在95%以上。类似于Myocet,Marqibo的产品包装中也是三个小瓶,空白脂质体的内水相为柠檬酸缓冲液(pH≈4.0,0.3M),在包载硫酸长春新碱(pKa= 5.4)前,加入浓度为14.2 mg/mL的磷酸钠缓冲液,使脂质体外水相的pH约为7.0~7.5。
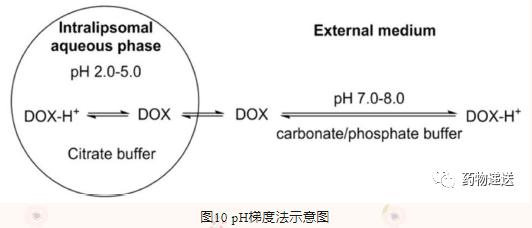
与Myocet和Marqibo不同,DauoXome采用低pH梯度(柠檬酸,50mM)主动载药,导致柔红霉素的包封效率较弱,药物半衰期较短,AUC较低。相反,高跨膜pH梯度(如脂质体内腔pH=2.0)可增加脂质体的药物包封率和抗肿瘤疗效。然而,低pH会引起脂质(如磷脂酰胆碱)的酸水解,进一步引起脂质体的药物泄漏和稳定性问题。
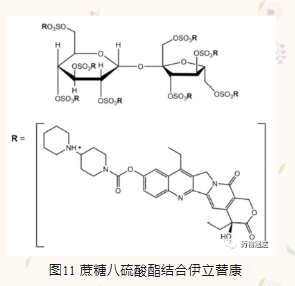
Onivyde使用一种新型聚阴离子盐蔗糖八硫酸酯三乙基铵盐(TEA-SOS),在脂质体膜内外产生电化学梯度。一分子聚阴离子盐可以与八分子伊立替康结合。首先在TEA-SOS溶液中制备脂质体,未包载的TEA-SOS在外水相溶液置换时去除,空白脂质体在pH=6.5的条件下与盐酸伊立替康溶液孵育。包裹在脂质体内部的伊立替康呈现为胶凝或沉淀状态,包封效率可到95%以上。
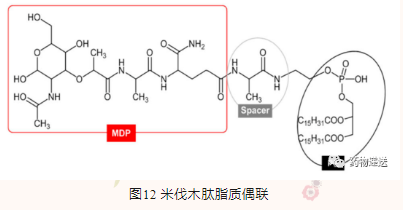
(3)药物-脂质共价偶联
通过连接子将药物分子与脂质体共价偶联是另一种包载药物的有效策略,例如Mepact。胞壁酰二肽(MDP)是革兰氏阳性菌细胞壁的主要组成成分,具有增强免疫反应的能力。由于MDP是低分子量的水溶性分子,因此其脂质体存在包封效率低、贮存过程中药物泄漏等问题。为了提高MDP的脂溶性,通过将MDP与磷脂酰乙醇胺(PE)连接,形成MTP-PE(胞壁酰三肽-磷脂酰乙醇胺)。冻干产物(MTP-PE、POPC和OOPS)在生理盐水复溶重组过程中,MTP-PE的两亲分子插入到脂质体双层膜中。MTP-PE全部存在于脂质体内,未发现游离MTP-PE。
(4)组合方法载药
Vyxeos(阿糖胞苷和柔红霉素)同时采用被动载药和主动载药,这是被批准的在同一个脂质囊泡内装载两种不同药物的脂质体产品。
简而言之,当用葡萄糖酸铜、三乙醇胺(TEA)、pH7.4和阿糖胞苷溶液水化脂质体时,阿糖胞苷被动包载于脂质体中。减小粒径后将未包裹的药物和葡萄糖酸铜/TEA进行溶液置换后,柔红霉素缓冲溶液在中性pH下与包载阿糖胞苷的脂质体孵育。柔红霉素通过葡萄糖酸铜/TEA包载的方式蓄积于脂质体内腔中。柔红霉素通过脂质双分子层扩散到脂质体内,而中性形式的TEA渗透到脂质体外,在柔红霉素和TEA外排之间建立了动力学和化学计量学的关系。葡萄糖酸铜/TEA在与两种药物的相互作用中起关键作用,保持两种药物在脂质体内的滞留,并调节脂质体的药物释放。
五、已上市脂质体的关键质量属性
与传统的药物剂型(如小分子注射剂)不同,脂质体包载的治疗性分子在全身给药后(如静脉注射)递送到肿瘤细胞更为复杂,主要经过以下步骤:
(a)血管内外渗至组织间隙:脂质体通过扩散和/或对流穿过肿瘤血管壁不连续内皮连接(100nm-2μm)进入肿瘤间质。同时,一部分脂质体被MPS从体循环中清除,特别是粒径较大(>200nm)、表面疏水或带电荷(负电荷或正电荷)的颗粒。(b)递送至肿瘤细胞:脂质体通过扩散和对流的间质递送接近单个肿瘤细胞。采用主动靶向的策略对脂质体进行表面修饰,可以克服粒子在细胞外基质中扩散的物理阻力,因为脂质体上的靶向配体与肿瘤细胞表面的受体之间会产生更高的亲和性。(c)黏附于细胞膜:脂质体通过非特异性或特异性结合黏附于细胞膜上。(d)胞吞、膜融合或扩散进入细胞:脂质体通过胞吞、膜融合或扩散进入细胞,胞吞作用的方式取决于粒子的大小,200nm和500 nm的颗粒通过网格蛋白和小窝蛋白介导的胞吞作用,5μm的粒子则通过大胞吞作用。(e)细胞内递送并释放药物:进入细胞内的脂质体释放包载药物。
基于脂质体的这种转运过程,由于循环中的脂质体颗粒无法穿过心脏血管的连续内皮连接,因此Doxil比传统的阿霉素溶液能明显降低心脏毒性。与常规药物相比,DaunoXome提高柔红霉素在肿瘤部位递送约10倍,,并在体内持续释放。
关键质量属性(Criticalquality attributions,CQAs)是产品的物理、化学、生物或微生物特性或特征,影响产品药代动力学和药效学性能。基于脂质体的药代动力学机制和性质,脂质体的CQAs通常包括颗粒粒径和粒度分布、形态、层状结构、表面性质(Zeta电位、PEG层厚度和靶向分子)、脂质膜的相变温度、载药量、释药速率等。例如,脂质体的层状结构会影响药物的释放速度,脂质体的形态会影响脂质体在体内的循环时间。
(1)粒径和粒度分布
如上所述,脂质体的整个药代动力学过程都依赖于粒子粒径,如系统循环和MPS的清除、外渗到组织间质、细胞外基质间转运、细胞摄取和细胞内转运等。粒径<200nm的颗粒可降低血清蛋白的调理作用和MPS的清除作用。对于Myocet,在小鼠白血病模型中,脂质体粒径越小抗肿瘤效果就越高,平均生存时间就越长。粒径为2.0~3.5μm的Mepact可促使单核/巨噬细胞吞噬,并触发对肿瘤治疗的免疫调节作用。
有研究表明,不同粒径的佐剂脂质体(ArmyLiposome Formulation,ALF)疫苗会产生不同的免疫反应,例如树突状细胞更容易摄取粒径在10~200nm范围内的小颗粒,而其他免疫细胞(如巨噬细胞)易于吞噬大颗粒。在口服胰岛素脂质体的研究中发现,粒径为150nm和400 nm的脂质体可以维持24h的低血糖水平,而粒径为80nm和2μm的脂质体则仅有短暂药理作用和无药理作用。
(2)表面改性
以高度灵活的PEG链包裹脂质体形成水合层是脂质体修饰的重要方法,它可以减少MPS的清除,延长循环时间,并防止脂质体聚集。另一种常见的脂质体表面修饰是使用配体进行主动靶向。
FDA指南建议可对纳米材料的水合层包双分子相互作用以及受体介导的细胞相互作用的影响。此外,水合层包衣材料应进行完整的表征和控制,衣厚度进行描述,因为包衣的覆盖密度和厚度影响细胞摄取并控制纳米颗粒在生物基质中的递送。EMA的回顾性报告中提到,应该考虑表面包衣以非共价或共价结合方式对产品稳定性、药代动力学、生物分布、包括其一致性和重现性、表面覆盖不均一性、配体的取向和构象状态、物理化学稳定性、过早脱离和/或涂层降解等。
(3)相变温度
脂质体脂质双层膜的相变温度是生产过程、储存过程中的稳定性和体内药物释放的关键参数。关于相变的大量研究已经完成,水化脂质双分子层呈现出三种层状形式:晶体相(Crystalphase)LC、“固态”凝胶相(“Solid”gel phase)(六角晶格Lβ和类六角晶格Lβ’)和液晶相(Liquid-crystalphase)Lα。在层状凝胶相中,酰基链优先排列成全反式,横向扩散非常缓慢。在凝固点转变温度TC下冷却,层状结构由凝胶相转变为晶体相。晶体相也被称为亚凝胶相;烃链处于完全伸展的全反式构象中,极性头基团相对不动。在从凝胶相到晶体相的转变过程中,可能会出现亚稳前体SGII相(也称为亚凝胶)或LR1相。将温度加热到熔点温度Tm以上,脂质膜从有序态(凝胶态)转变为相对无序的液晶态,烃链呈现快速的跨扭式波动,导致膜的渗透性增加,药物分子更容易跨膜。
通常,脂质层的熔点温度需要高于生理温度(37℃),因此,药物分子通过膜凝胶状态的速度很慢,可以更好地防止脂质体在体内的快速释放和药物泄漏,以降低全身毒性的风险。

六、展望未来
将脂质体(Liposomes)设置为关键词,在Scopus上搜索1970年~2020年与脂质体相关的文献。对这些结果进行统计可得到结论:
(1)脂质体作为药物载体应用于如食品、化妆品领域比应用于纳米药物更早(1970年VS1990年);(2)脂质体作为药物载体在脂质相关出版物中的应用随着时间的推移而增加,2000年为50%,2010年为70%,2020年为74%;(3)虽然纳米医学的发展滞后于脂质体的应用,但随着时间的推移,有关纳米医学的论文数量呈指数增长;(4)纳米药物脂质体在总纳米药物中所占比例极低(7%)可能是数据有误,因为2020年有3024篇关于脂质体药物的出版物。
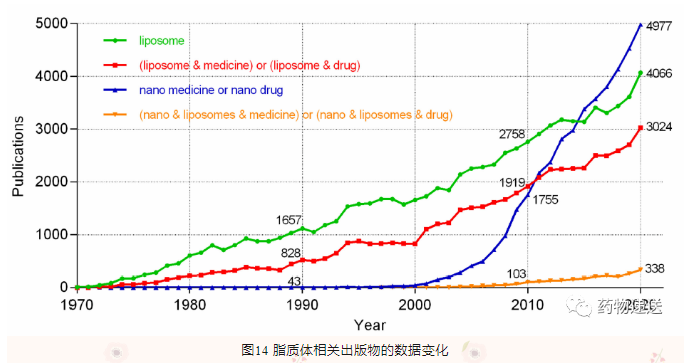
我们推测,与纳米粒子、纳米晶体或纳米悬浮液的名称相比,“纳米”和“脂质体”的名称组合可能使用较少。据FDA报道,截至2016年2月18日,已收到500多份脂质体申请。在这些申请中,除了约100份提交的脂质体与另一种治疗药物联合使用外,其余的申请(单独使用)中有3%的NDA、1%的ANDA和96%的IND。从实验室和制药行业收集的数据来看,不久的将来,将会有大量脂质体产品从实验室转化到中试生产并较终上市。
从1995年批准前列个脂质体产品Doxil开始,脂质体技术已经发展了20多年。在大量出版物和商业产品的基础上总结成功经验和痛点,脂质体可以经过精心设计,并根据人类的需求发挥预期的作用。一方面,在开发和商业化生产过程中存在着一些主要障碍,例如EPR效应的个体差异、聚乙二醇化脂质体的效果、加速血液清除(ABC)现象、工艺放大、不同生产批次和场地之间的重现性/一致性,以及辅料控制。
另一方面,大量的智能脂质体系统正在实验室开发或正在进行临床试验,如主动靶向脂质体(抗EGFR免疫脂质体,II期;MBP-426,II期)和敏感型脂质体(ThermoDox)。可以利用目标病变部位的微环境触发脂质体释放药物,外界或内部的刺激(如温度、pH值、光线、电磁场、酶和缺氧)经常被研究为药物释放的“开关”(On-Off)。虽然在临床前研究中取得了较好的结果,但由于载体在到达靶点前泄漏、患者个体差异以及涉及的多模式治疗等主要问题,临床转化成功仍面临挑战。开发较快的热敏脂质体ThermoDox在与射频消融术联合治疗肝细胞癌III期临床试验的第二阶段中失败。然而这些失败只是意味着脂质体产品在一定的临床设计下的失败,智能技术将为脂质体进一步提高疗效和降低副作用提供许更多的机会。
较近,一个关于“我们在纳米药物发展道路上处于什么水平(where are we in the development path of nanomedicines)”的话题被广泛讨论。当回顾历史上脂质体的应用情况和脂质体的性能时,我们保持乐观的态度。中国国家药监局已批准了五类脂质体产品:紫杉醇脂质体、盐酸阿霉素脂质体、两性霉素脂质体、盐酸米托蒽醌脂质体、盐酸伊立替康脂质体,其中紫杉醇脂质体和米托蒽醌脂质体为我国独有产品。此外,中国的大型制药行业和小型创新公司都在开发纳米药物,包括脂质体、纳米晶体、无机颗粒和聚合物胶束。与此同时,纳米药物安全性评价和质量监管课题被国家药品管理局纳入重点发展项目,相信纳米药物定有一个明朗的未来。(摘自“药物递送”)

Zhangshiqiang20230926