浙江微流纳米生物技术有限公司
湖南大学与湘雅医院在The Royal Society of Chemistry上联合发表文章《A hybrid membrane coating nanodrug system against gastric cancer via the VEGFR2/STAT3 signaling pathway》。Liposome Extruder(脂质体挤出器)在文章中得到多次应用。

图1.发表文章首页
血管内皮生长因子(VEGF)在许多胃癌患者中是一个重要的致癌基因。越来越多的证据表明,VEGF/VEGFR2通路的异常激活不仅可以促进新血管的生成,还可以加速细胞增殖和迁移,诱发血管通透性加重,加剧肿瘤微环境缺氧和酸中毒,显著抑制肿瘤免疫功能,多层次促进恶性发展。癌细胞中的STAT3可立即调节包括连续激活后的VEGF在内的多种癌基因的表达。VEGF可以激活STAT3以在癌细胞中产生信号前馈回路。因此,抑制VEGFR2被认为是重要的抗癌策略。
作为小分子VEGFR2抑制剂,通过特异性靶向细胞内激酶ATP结合位点以抑制磷酸化,阿帕替尼(AP)发挥了强大的抗血管生成功能。
华蟾素 (CS-1) 是具有良好抗肿瘤和抗炎活性的化合物。据研究表明,它可以通过靶向几个重要的肿瘤信号通路来发挥抗癌作用。
红细胞膜 (RBC)可以稳定抵抗体内纳米颗粒(NPs)的清除机制以延长体循环半衰期。而癌细胞膜 (CCM)包裹的纳米颗粒可以增强药物在肿瘤部位的富集。因此,包覆了红细胞和癌细胞杂化膜(R/C)的纳米颗粒可以同时延长半衰期并提高药物作用于肿瘤部位的靶向性。
基于AP 和 CS-1水溶性差,体内半衰期短与生物利用度低的缺陷,结合纳米药物载体的独特优势,文章研究了以pH响应型脂质体纳米颗粒作为药物载体共同递送药物AP和CS-1(LP@AC)。纳米粒子进一步包覆于源自红细胞(RBC)和癌细胞(CCM)的杂化膜(R/C),较终获得纳米药物复合物(LP-R/C@AC NPs)。
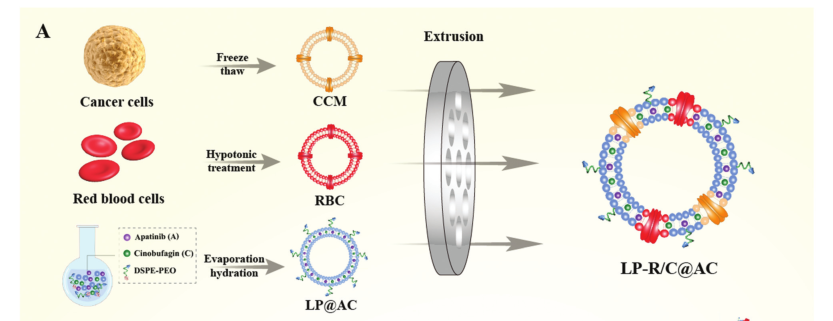
图2. 纳米药物复合物(LP-R/C@AC NPs)制备概图
研究结果表明,构建的纳米药物复合物(LP-R/C@AC NPs)不仅能通过诱导细胞凋亡、自噬和细胞焦亡来有效杀死肿瘤,还显著抑制肿瘤通过 VEGFR2/STAT3 通路侵袭和转移。
新开发的纳米药物复合物有望应用于晚期胃癌的临床治疗。

图3. Liposome Extruder(脂质体挤出器)在文章中的应用
Liposome Extruder(脂质体挤出器)分别在杂化膜(R/C),载药脂质体(LP@AC)与纳米药物复合物(LP-R/C@AC NPs)的制备过程中得到应用。目的均为获得均一的颗粒。

图4. Liposome Extruder(脂质体挤出器)
Liposome Extruder(脂质体挤出器)具有操作简便,滤膜规格选择多样性等特点,其应用领域包括但不限于医药,化妆品等科研实验。
更多详情请联系
 | 王经理 |
Jin220511M