浙江微流纳米生物技术有限公司
纳米乳液是指由水相、油相、表面活性剂等多组分混合而成的胶体分散体系,液滴粒度一般在100~200 nm。目前,纳米乳液由于粒度较小且尺度均一、稳定性较好、黏度较低等优点在食品乳液领域显示出广泛的应用前景。大分子蛋白质和小分子表面活性剂是较为常用的2 种用于稳定食品纳米乳液的表面活性物质,而为提升生产效率,这2 种类型的表面活性物质通常复合使用以获得稳定性较好的乳液体系。
微射流均质机在制备纳米乳液过程中表现出快速高效且重复性强的性能,配备金刚石交互容腔的对射微射流高压均质机被越来越多得用于纳米乳的制备。
大豆分离蛋白(soy protein isolate,SPI)是一种优质植物性食物蛋白质,含有多种氨基酸,具有较高的营养价值。SPI具有两亲性,能在油-水界面进行扩散、吸附,可用于稳定油-水界面。甜菊糖苷(steviol glycosides,STE)是一类从甜叶菊叶子中提取的天然低热值的甜味剂,其甜度是蔗糖的200~300 倍,被称为“世界第三糖源”,可作为食品添加剂在亚洲、北美、欧盟等市场使用。STE具有降血压、降血糖、抗肿瘤、免疫调节等重要的生物活性。其分子结构由亲水性的双侧糖基(葡萄糖基和鼠李糖基)和疏水性的甜菊醇基连接构成,是一种典型的两亲性结构。有研究证实STE可发展为一种新型的天然表面活性剂,与大豆蛋白复合可显著提升蛋白的界面活性及乳液、泡沫的形成和稳定性。
本实验将探索植物蛋白-甜菊糖苷复合体系作为天然稳定剂,采用高压微射流均质制备尺度小于200 nm且稳定性良好的纳米乳液体系,测试乳滴粒度、电位及形态,并研究微射流均质过程等对纳米乳液形成的影响。
材料与试剂
低温脱脂豆粕;甜菊糖苷(总苷>95%);葵花籽油等
仪器与设备
粒度分布仪;高压微射流纳米均质机;原子力显微镜 等
实验方法
1 SPI的制备
采用碱溶酸沉的方法制备SPI。
2 SPI-STE复合体系的制备
称取一定量的SPI和STE样品,分别溶于磷酸盐缓冲液(pH 7.0)中,在室温匀速搅拌2 h。将搅拌后的SPI和STE溶液在4 ℃放置过夜12 h,以确保蛋白充分水化。分别将SPI和STE溶液的pH值调节至7.0后,按一定比例混合,配制出一系列不同质量分数的SPI-STE混合溶液,在室温匀速搅拌,以保证SPI和STE之间充分反应。
3 SPI-STE复合体系乳液的制备
将SPI-STE混合溶液和葵花籽油以一定比例混合,室温搅拌。将混合液经高速剪切机预均质后得到粗乳液,再经微射流均质处理后得到细乳液。较终的乳液组成为:分散相(油相)为10%~40%,连续相(水相)为磷酸盐缓冲液(pH 7.0),乳化剂中SPI质量分数恒定为1%,STE质量分数为0%~2%。将乳液的pH值调节为7.0,较后加入抑菌剂,以抑制微生物的生长。
4 乳液的粒度测定
选用制备新鲜乳液的粒度分布评估大豆蛋白纳米乳液的乳化性质,采用粒度分布仪测定乳液油滴的粒度大小。
5 乳液的Zeta电位测定
将制备好的大豆蛋白纳米乳液用磷酸盐缓冲液(pH 7.0)稀释200 倍,装入2 mL的塑料密封管中,采用纳米粒度及电势仪测定乳液液滴的Zeta-电位(mV)。
6 原子力显微镜观察
采用轻敲模式, 装有G I I 型扫描探头并由NanoscopeIIIa控制器驱动Dimension 3000显微镜。将1% SPI-1% STE复合体系制备的稳定乳液用相同的缓冲液稀释200 倍,并取2 μL稀释样品滴在新鲜剥离的云母片表面,在空气中过夜干燥。扫描条件:频率300 kHz,速率1 Hz。使用Digital Nanoscope软件分析获得的图片。
7 乳液稳定性测定
选取微射流均质条件为50 MPa,处理3 次制备不同复合体系稳定的乳液。将制备好的细乳液立即分装到可密封的乳液管中,盖紧密封后将乳液于室温下放置30 d,每隔一定时间(1、3、7、14、21、30 d)测定乳液的粒度变化,并记录乳液外观的变化情况。
结果与分析
1 纳米乳液粒度分析
图1表明复合稳定剂体系的乳化能力随STE的添加而逐渐增强,主要是因为STE的添加使稳定剂体系显示了更强的降低油-水界面张力的能力,因而有利于乳液的形成。由图1B可知,STE质量分数为0.5%和1%时,形成的乳液的d43值和d32值均在200 nm以下,表明形成了纳米乳液。进一步增加STE质量分数至2%,与SPI-1% STE稳定的乳液相比,乳液的粒度分布及d43、d32的值均未发生明显变化。这可能是因为此时这2 个稳定剂体系的起始界面张力值相似,因而形成尺度一致的纳米乳液。
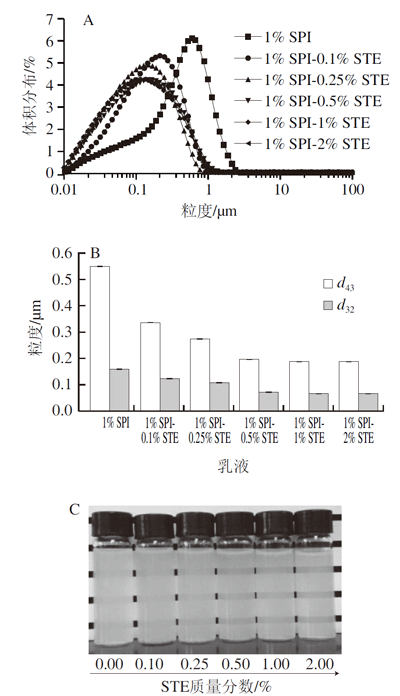
图 1 SPI-STE复合稳定的新鲜乳液粒度分布(A)、粒度值变化(B)和稀释后纳米乳液外观图(C)
如图1C所示,制备的新鲜乳液稀释20 倍后油相质量分数为0.5%。可以看到,与单独SPI乳液相比,SPI-STE复合稳定的纳米乳液均呈现透明或半透明状态,尤其在STE质量分数为0.5%~2%时更为明显,这归因于逐渐减小的纳米乳液粒度,与图1A、B的粒度结果分析一致。
2 纳米乳液微结构表征

图 2 1% SPI-1% STE复合稳定的纳米乳液原子力显微镜图
如图2所示,1% SPI-1% STE复合稳定纳米乳液的乳滴呈球形,乳滴粒度较小且分布均匀,这与粒度测试的结果(图1A、B)基本一致,进一步证实了纳米乳液的形成。
3 纳米乳液Zeta电位表征
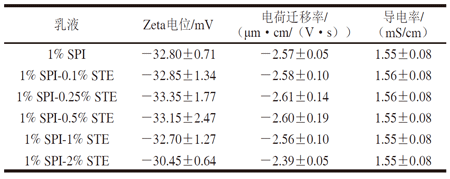
表 1 SPI-STE复合稳定的纳米乳液的Zeta电位
Zeta电位是带电粒子双电层产生的电势,用以反映纳米颗粒表面的带电性质。由表1可知,与单独SPI稳定的乳液相比,添加STE并未引起乳液Zeta电位、电荷迁移率及导电率出现明显变化,电位值基本保持在稳定范围内(绝对值大于30 mV),这表明STE质量分数变化对乳滴表面电势没有影响。
4 纳米乳液的长期稳定性
通过检测纳米乳液d43值随着贮存时间的变化情况来评估纳米乳液的长期稳定性,乳液微射流均质压力为50 MPa,均质次数为3 次。将乳液室温放置30 d,并每隔一定时间(1、3、7、14、21、30 d)测定乳液的粒度,并记录乳液外观的变化情况,结果如图3所示。
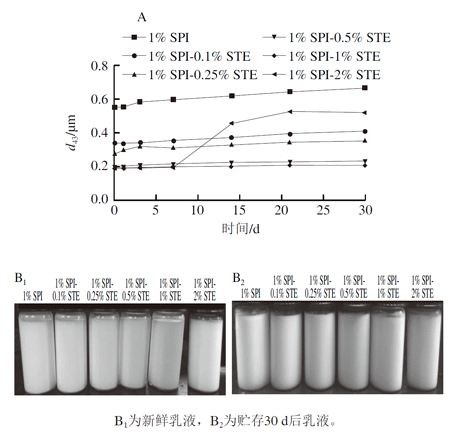
图 3 SPI-STE复合体系稳定的纳米乳液平均粒度(d43)随贮存时间变化(A)和贮存乳液外观(B)
大分子蛋白质能形成高弹性的界面膜,从界面角度来分析,蛋白乳液一般具有较高的稳定性,但蛋白乳液长期放置后也较易发生乳滴絮凝、聚结、乳析等不稳定现象。由图3A可知,随着放置时间的延长,单独1% SPI稳定的乳液d43值逐渐变大,在30 d时达到0.638 μm。图3B为乳液放置前后的外观变化,可以看出,单独SPI乳液在放置30 d后底部出现了明显的相分离(乳析),该不稳定现象可能是由单独SPI稳定的乳液油滴在放置过程中发生絮凝、聚合等而造成的。
与单独SPI相比,SPI-STE复合体系制备的纳米乳液稳定性显著提高。可以发现,当加入适当质量分数的STE(0.1%~1%)时,尤其在0.5% STE和1% STE时,乳液的d43值在放置30 d后仅呈现轻微增加;并且从图3B中也可以看出,这些纳米乳液经30 d贮存后未出现明显的乳析和分层现象,说明其具备较好的长期稳定性。前期研究表明,大豆蛋白与STE在体相溶液中可通过疏水相互作用发生非特异性结合,该结合促进蛋白质分子在界面上进一步伸展,使SPI-STE复合体的协同界面活性比单独SPI界面活性高,且形成的复合界面具有相对稳定的弹性以防止界面膜破裂,从而有利于乳液稳定性的提高。
当STE质量分数达到2%时,乳液经过30 d静置贮存后其d43值从0.188 μm增加到0.503 μm,且该乳液在放置7 d后粒度d43已开始出现明显增加。这说明过高质量分数的STE(2%)也会导致乳液的稳定性变差。

更多详情请联系
 | 王经理 |
Jin210910M