浙江微流纳米生物技术有限公司
本文将从FDA(Food and Drug Administration)和GMP(Good Manufacturing Practices)的要求出发,介绍URS、DQ、IQ、OQ、PLC确认和PQ的组织构架,列出各个确认过程的主要检查项目。
用户需求规格(URS)
URS(User Requirement Specification)即用户需求说明,是指使用方对设备、厂房以及硬件设施系统等提出期望使用需求说明,设计方依据需求提出自己具体的方案,供应商依据客户提供的URS方案设计施工。URS是验证获得成功的较关键的前列步,有了URS才会有进一步的验证活动,没有URS的验证过程是盲目的。因此,制定一个科学合理、符合相应法规标准的URS将为项目的整体有效快速的推进打下良好的基础。URS一般由用户自己编写,也可以由供应商编写;随后由用户的项目经理、验证人员以及质保部门共同审批之后作为采购合同的有机组成部分。较终的URS,往往是双方多次反复协商之后达成的。下面是URS一般包括的内容:
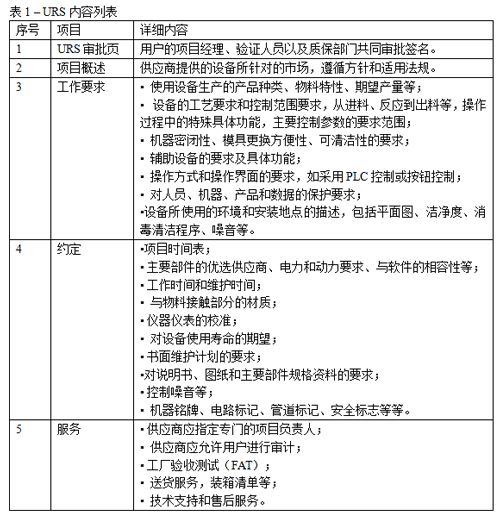
表1.URS内容列表
一份编写良好的URS,不仅考虑工艺要求,而且考虑与GMP的符合性以及验证要求。
有几个值得注意的地方:前列,在确定设备生产的产品种类时,必须确保产品分隔和清洁验证。第二,选用供应商推荐的一些新功能时,应考虑这些功能是否可验证。第三,需要关注辅助设备的性能,例如设备是否符合GMP的密闭性要求。第四,尽早提出说明书、图纸、主要部件规格资料以及维护计划的要求,以方便供应商收集资料。第五,如果后续的验证要求对供应商进行审计,那么也应当在URS中提出审计范围和审计要求,以方便相应人员安排行程。第六,可与供应商约定尽量使用出厂日期在一年以内的仪表,以降低购买后的校准需求。
设计确认(DQ)
DQ(Design Qualification),即设计确认,由设备需要部门直接的技术人员和工程人员合作完成,应当证明厂房、设施、设备的设计符合预定用途和要求,记录设施、设备系统按照GMP要求进行设计的书面证据,而这些书面证据必须说明所设计的设施、设备系统适合于用户的目的用途,并且所设计的设施、设备系统组元和单元依据现行的工程理论与实践原则以及用户要求。

表2.DQ检查项目和描述
DQ一般针对定制系统进行,例如水系统、空调系统、软件等。对于批量生产、变化较小、买来就用的商品(off-the-shelf,OTS),是否进行DQ由用户的验证主计划VMP(VALIDATION MASTER PLAN)决定。大部分用户只有URS,而不做DQ。如果VMP中没有对DQ做出规定,也没有DQ管理的SOP,那么就说明厂家目前所针对的市场没有这方面的法规要求。这种情况下,是否做DQ完全由用户的意愿决定。
如果制药企业原来针对的是中国市场,随后想开发其它国家市场,是否有必要对现有设备重新做DQ呢?答案是否定的。DQ的目的是在设计阶段确认设计与GMP和使用用途的符合性。如果设备已经开始用了,IQ、OQ和PQ已经证明与GMP的符合性,使用情况也很清楚了,DQ还有什么意义呢?如果DQ失败,现有设备是不是应该马上停止使用?实际上,已经使用的系统属于“已有系统(Legacy System)”,制药企业可在VMP中对已有系统的验证做出规定,例如在再验证时补充部分OQ和PQ、回顾以前的使用情况和偏差等等。如果需要对现有系统进行评估和改造,可以进行差距分析(Gap Analysis),确定改造方案后再进行新方案的DQ。
DQ的主要目的有三个,一是确认是否符合URS,二是确认是否符合VMP,三是确认是否符合GMP。对于制药用水系统和空调系统这类特别重要又比较复杂的系统,DQ涉及适用性、有效性、可制造性、可靠性、可维护性、安全性、生产率和其它因素的确认,可以委托给第三方进行。OTS商品的DQ就是对URS各项要求的确认。简单地说,URS中的各项陈述就是DQ的接受标准。一份编写良好的URS应考虑VMP和GMP的要求,这样DQ与URS的各个部分可一一对应。在DQ中涉及产品分隔和清洁验证的检查,可以将VMP中的相应部分直接复制过来。
安装确认(IQ)
IQ(Installation Qualification)主要是对校准、维护、证明和资料的检查,下面是IQ的检查项目和内容:
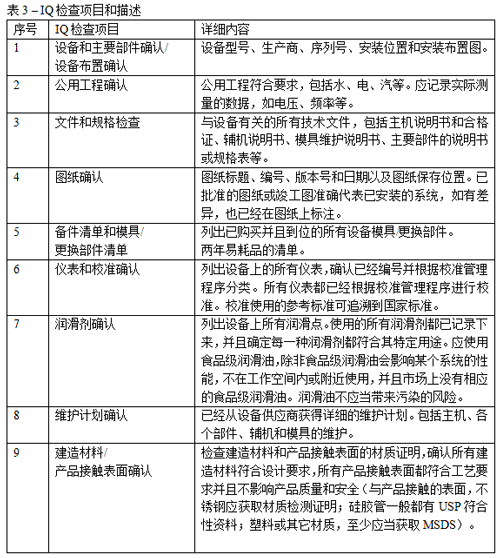
表3.IQ检查项目和描述
IQ中很大部分是第3部分,即对文件和规格表的检查。这部分对设备维护尤其重要。在许多个国内制药设备厂家的说明书中,重要部件的维护说明经常遗漏或者与部件生产商的说明有出入,如减速机油的型号选择、真空油的更换频率、不同轴承的润滑方案等。另外,辅机和模具经常缺乏维护说明。这些内容的缺失可能影响用户的使用和维护,导致故障率上升或者不正确的维护。例如轴承加速磨损,润滑剂选择错误从而影响机器性能,甚至还有客户用食用油保存模具的情况。用户应当向设备制造商获取部件生产商的说明书,才能得到比较正确的说明。如果某个配件坏了,根据规格表可以很快从当地买到可替代的型号,而不必等待从厂家邮寄配件。除此之外,另一个工作比较繁重的部分是第4部分,即图纸确认。应根据图纸逐项检查机器,确认其与图纸的符合性。这部分检查也是对维护人员和操作人员进行培训的好机会。

第二代微射流金刚石交互容腔的应用,使得Genizer微射流纳米高压均质机集合微射流、撞击流和传统高压均质技术的优势于一体。
更多详情请联系
 | 王经理 |
Jin210823M